Células madre modificadas combaten la artritis
Utilizando una nueva tecnología de modificación genética, los investigadores han reconectado las células madre de ratones para combatir la inflamación causada por la artritis y otras enfermedades crónicas
-
Medicina estética: confianza y bienestar
-
La evidencia científica y la experiencia en pacientes: claves que respaldan el uso de Sculptra®
El tratamiento está avalado por más de 20 años de uso clínico, más de 50 publicaciones científicas y datos procedentes de más de 10.000 pacientes2
-
mesoestetic® destaca en IMCAS 2026 con la segunda generación de mesofiller nexha, basada en una sinergia inédita de activos
mesoestetic® brilla en IMCAS París 2026 con el lanzamiento internacional de la segunda generación de mesofiller® nexha, una innovadora sinergia de activos que marca un nuevo hito en medicina estética
-
¿En serio hablamos de esperma de salmón?
Las redes sociales y los medios de comunicación no hablan de otra cosa: el tratamiento basado en medicina regenerativa para rejuvenecer de manera natural... ¿pero de verdad viene del esperma de salmón?
-
IMCAS China 2025: Shanghái se convierte en el epicentro de la medicina estética global
IMCAS China 2025 reunirá a expertos internacionales en medicina estética en Shanghái del 11 al 13 de julio. El evento promete ser una vitrina de innovación, formación avanzada y oportunidades comerciales en el dinámico mercado asiático
-
AMWC Americas 2026: la medicina estética global regresa a Miami
Del 14 al 16 de febrero de 2026, el JW Marriott Miami Turnberry Resort & Spa acogerá una nueva edición del AMWC Americas, el congreso líder en medicina estética y antienvejecimiento
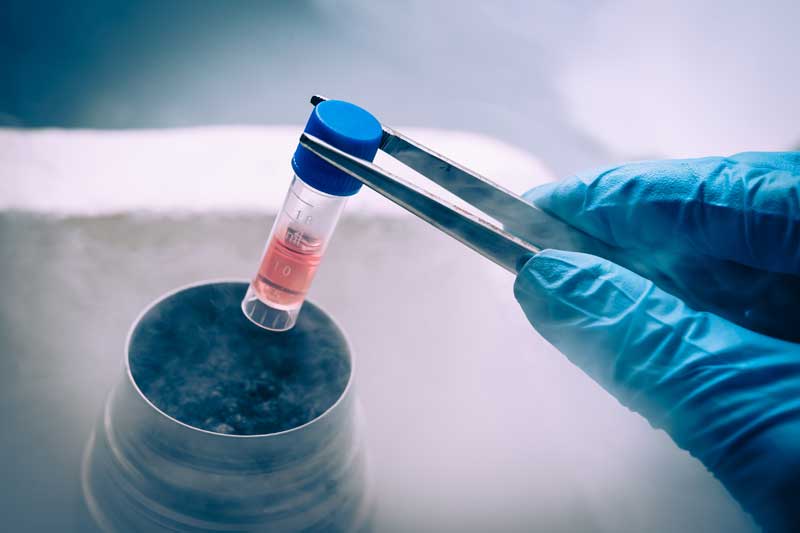
Con la nueva tecnología de modificación genética, los investigadores han reconectado las células madre de ratones para combatir la inflamación causada por la artritis y otras enfermedades crónicas. Estas células madre, conocidas como células Smart (células madre modificadas para terapia regenerativa autónoma), se convierten en células de cartílago que producen un fármaco antiinflamatorio biológico que, en el futuro, reemplazará el cartílago artrítico y simultáneamente protegerá las articulaciones y otros tejidos de los daños que ocurren con inflamación crónica.
Las células se desarrollaron en la Escuela de Medicina de la Universidad de Washington en St. Louis y Shriners Hospitals for Children-St. Louis, en colaboración con investigadores de Duke University y Cytex Therapeutics Inc., ambos en Durham, N.C. Los investigadores inicialmente trabajaron con células de la piel tomadas de la cola de ratones y convirtieron esas células en células madre. Luego, utilizando la herramienta de edición de genes CRISPR en células producidas en cultivo, se eliminó un gen clave en el proceso inflamatorio que reemplazó con un gen que libera un fármaco biológico que combate la inflamación.
"Nuestro objetivo es empaquetar las células madre reconectadas como una vacuna para la artritis, resultando un fármaco antiinflamatorio para intervenir sobre una articulación artrítica, pero sólo cuando sea necesario", dijo Farshid Guilak, PhD, autor principal del libro y profesor de Cirugía ortopédica en la Escuela de Medicina de la Universidad de Washington. "Para hacer esto, necesitamos crear una 'célula inteligente'".

Muchos medicamentos actuales utilizados para tratar la artritis (incluyendo Enbrel, Humira y Remicade) atacan una molécula promotora de la inflamación llamada factor de necrosis tumoral alfa (TNF-alfa). Pero el problema con estos fármacos es que se administran sistemáticamente en lugar de dirigirse a las articulaciones. Como resultado, interfieren en el sistema inmunológico de todo el cuerpo y pueden hacer que los pacientes sean susceptibles a efectos secundarios como las infecciones.
"Queremos utilizar nuestra tecnología de modificación genética como una forma de ofrecer terapia dirigida en respuesta a la inflamación localizada en una articulación, en comparación con las terapias de medicación actuales que pueden interferir con la respuesta inflamatoria a través de todo el cuerpo", dijo Guilak, profesor de biología del desarrollo y de ingeniería biomédica y co-director del Centro de Medicina Regenerativa de la Universidad de Washington. "Si esta estrategia demuestra ser exitosa, las células manipuladas solo bloquearían la inflamación cuando se liberen señales inflamatorias, como durante una llamarada artrítica en esa articulación".
Como parte del estudio, Guilak y sus colegas cultivaron células madre de ratón en un tubo de ensayo y luego utilizaron la tecnología CRISPR para reemplazar un mediador crítico de la inflamación con un inhibidor de TNF-alfa.
"Explorando herramientas de biología sintética, encontramos que podríamos codificar de nuevo el programa que las células madre usan para orquestar su respuesta a la inflamación", dijo Jonathan Brunger, PhD, el primer autor del libro y un postdoctorado en farmacología celular y molecular en la Universidad De California, San Francisco.
En el transcurso de algunos días, el equipo dirigió las células madre modificadas para crecer en células del cartílago y producir el tejido del mismo. Otros experimentos realizados por el equipo mostraron que el cartílago manipulado estaba protegido contra la inflamación.
Los investigadores también codificaron las células del tallo / cartílago con genes que hicieron que las células se iluminaran al responder a la inflamación, por lo que los científicos fácilmente podrían determinar cuándo las células estaban respondiendo. Recientemente, el equipo de Guilak ha comenzado a probar las células madre manipuladas en modelos de ratones con artritis reumatoide y otras enfermedades inflamatorias.
Si el trabajo se puede replicar en animales y luego desarrollarse en un tratamiento clínico, las células o cartílago manipulados producidos a partir de células madre responderían a la inflamación mediante la liberación de un fármaco biológico (el inhibidor del TNF-alfa) que protegería las células sintéticas del cartílago que el equipo de Guilak ha creado y las células naturales del cartílago en articulaciones específicas.
"Cuando estas células detectan TNF-alfa, activan rápidamente una terapia que reduce la inflamación", explicó Guilak. "Creemos que esta estrategia también puede funcionar para otros sistemas que dependen de un bucle de retroalimentación. En la diabetes, por ejemplo, es posible que podamos hacer células madre que podrían detectar la glucosa y activar la insulina en respuesta. Estamos usando células madre pluripotentes, por lo que podemos fabricarlas en cualquier tipo de célula, y con CRISPR, podemos eliminar o insertar genes que tienen el potencial para tratar muchos tipos de trastornos".
Con la vista puesta en nuevas aplicaciones de este enfoque, Brunger añadió: "La capacidad de construir tejidos vivos de células madre inteligentes que responden precisamente a su entorno abre posibilidades emocionantes para la investigación en medicina regenerativa".

Recomendamos