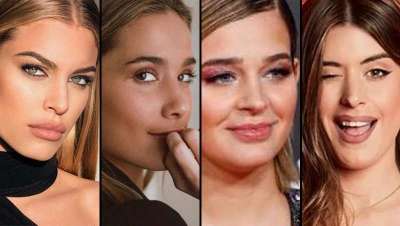RMD 2019 aterriza en USA
Este interesante ciclo de conferencias sobre el Nuevo Reglamento Europeo de Dispositivos Médicos se celebrará en junio en Nueva Jersey, EE UU
-
ESAM Medicina Estética, un nuevo impulso para el sector
-
El manual definitivo para la eficaz aplicaciĂłn de fillers
AnatomĂa facial para la aplicaciĂłn de la toxina botulĂnica y rellenos es un libro de gran utilidad para cualquier personal sanitario que realice este tipo de tratamientos
-
MarĂa Pombo, Jessica Goicoecha, Laura Escanes y Dulceida, los retoques estĂ©ticos de las influencers
Hoy, cuatro de nuestras socialitĂ©s más famosas nos descubren sus principales retoques estĂ©ticos y cĂłmo estos han cambiado su fisionomĂa... ¡a mejor!, por supuesto
-
La Ăşltima generaciĂłn de inyectables de ácido hialurĂłnico para el rejuvenecimiento ya está aquĂ
Revisamos los productos para el relleno de lĂneas de expresiĂłn y rejuvenecimiento y destacamos algunas de las caracterĂsticas que los definen
-
Nace GloMask, la única máscara facial certificada como dispositivo médico
En solo 8 semanas semanas de uso, siguiendo el protocolo recomendado de 10 minutos/3 dĂas por semana, se observa una reducciĂłn de las arrugas y una piel más firme, luminosa y tersa
-
AMWC Americas 2026: la medicina estética global regresa a Miami
Del 14 al 16 de febrero de 2026, el JW Marriott Miami Turnberry Resort & Spa acogerá una nueva ediciĂłn del AMWC Americas, el congreso lĂder en medicina estĂ©tica y antienvejecimiento
La Conferencia Americana sobre el Nuevo Reglamento Europeo de Dispositivos Médicos (RMD 2019-USA) se celebrará del 13 al 14 de junio de 2019 en Nueva Jersey, EE UU.
RMD 2019-USA continĂşa la estela de sus antecesores europeos (Praga 2016, BerlĂn 2017, Bruselas 2018). Junto con EAAR (AsociaciĂłn Europea de Representantes Autorizados), grandes profesionales con experiencia en este campo ofrecerán conferencias realmente interesantes.

Los temas a tratar, entre otros, serán:
- ImplementaciĂłn del Nuevo Reglamento.
- El camino hacia 2020: panorama general de desarrollos normativos.
- Principales desafĂos de cumplimiento normativo para la industria.
- Retos para las autoridades nacionales competentes.
- Nuevos desafĂos legales para la industria de dispositivos mĂ©dicos.
- Alcance, fronteras y clasificaciĂłn.
- Requisitos generales de seguridad y rendimiento.
- Aspectos prácticos de la evaluaciĂłn clĂnica: quĂ© se debe actualizar ahora y cĂłmo planificarse.
- Cumplimiento futuro bajo el MDR.
- Impacto de las Regulaciones MD / IVD en los Sistemas de GestiĂłn de Calidad.
- Vista de un organismo notificado sobre los pasos de implementaciĂłn de MDR.
- Análisis postmercado.
- ¿Necesita planificación para PMCF?, ¿cuáles son las posibilidades de recopilar datos?
- El impacto del aumento de la transparencia y la trazabilidad resultante de Eudamed y la IntroducciĂłn de UDI.
- Vigilancia.
- ¿Qué podemos esperar del representante autorizado de MDR?
- Problemas especiales de DIV.
- Software.
- Conflictos entre operadores econĂłmicos.
Estos temas se actualizarán una vez que se complete la agenda definitiva.

Recomendamos