Más allá de la barrera cutánea: el papel de la inflamación tipo 2 en la dermatitis atópica a través de las edades
Reproducimos lo más destacado del simposio patrocinado por Sanofi y Regeneron Pharmaceuticals durante el congreso de la Academia Europea de DermatologĂa 2022
-
Medicina estética: confianza y bienestar
-
La evidencia cientĂfica y la experiencia en pacientes: claves que respaldan el uso de Sculptra®
El tratamiento está avalado por más de 20 años de uso clĂnico, más de 50 publicaciones cientĂficas y datos procedentes de más de 10.000 pacientes2
-
mesoestetic® destaca en IMCAS 2026 con la segunda generación de mesofiller nexha, basada en una sinergia inédita de activos
mesoestetic® brilla en IMCAS ParĂs 2026 con el lanzamiento internacional de la segunda generaciĂłn de mesofiller® nexha, una innovadora sinergia de activos que marca un nuevo hito en medicina estĂ©tica
-
ÂżEn serio hablamos de esperma de salmĂłn?
Las redes sociales y los medios de comunicaciĂłn no hablan de otra cosa: el tratamiento basado en medicina regenerativa para rejuvenecer de manera natural... Âżpero de verdad viene del esperma de salmĂłn?
-
AMWC Americas 2026: la medicina estética global regresa a Miami
Del 14 al 16 de febrero de 2026, el JW Marriott Miami Turnberry Resort & Spa acogerá una nueva ediciĂłn del AMWC Americas, el congreso lĂder en medicina estĂ©tica y antienvejecimiento
-
IMCAS China 2025: Shanghái se convierte en el epicentro de la medicina estética global
IMCAS China 2025 reunirá a expertos internacionales en medicina estética en Shanghái del 11 al 13 de julio. El evento promete ser una vitrina de innovación, formación avanzada y oportunidades comerciales en el dinámico mercado asiático
La dermatitis atĂłpica (EA) pediátrica es comĂşn. El estudio EPI-CARE (discutido a continuaciĂłn), por ejemplo, informĂł que el 12.1% de los niños de entre 6 meses y 5 años en 18 paĂses tenĂan EA. La prevalencia de EA fue similar en todos los grupos de edad: 13,0% de las personas de 6 a 11 años y 14,8% de las personas de 12 a 17 años.1 La EA, especialmente cuando es moderada o grave, puede tener un impacto perjudicial en la vida del niño y en las actividades de la familia.2,3 Sin embargo, muchos niños elegibles con EA moderada a grave no reciben terapias sistĂ©micas y todavĂa tienen una enfermedad no controlada, medida por la frecuencia y la duraciĂłn de los brotes.4
En este contexto, el simposio educativo (patrocinado por Sanofi y Regeneron Pharmaceuticals) celebrado durante el congreso de la Academia Europea de DermatologĂa y VenereologĂa (EADV) de 2022, revisĂł la carga de la EA en los niños y sus cuidadores. El simposio tambiĂ©n considerĂł los desarrollos recientes en el tratamiento de la EA pediátrica moderada a grave.5,7
Otro segundo simposio educativo durante el congreso EADV 2022 explorĂł la interrelaciĂłn entre la inflamaciĂłn tipo 2, la disfunciĂłn de la barrera cutánea y la desregulaciĂłn neuroinmune en la EA. La inflamaciĂłn tipo 2 involucra varias cĂ©lulas (por ejemplo, linfocitos T-helper 2 [Th2], eosinĂłfilos, mastocitos, basĂłfilos y cĂ©lulas linfoides innatas tipo 2) y varias citoquinas (por ejemplo, IL-4, IL-13 e IL-5).8 Los oradores revisaron las vĂas a travĂ©s de las cuales la inflamaciĂłn tipo 2 socava la integridad de la barrera cutánea y promueve la neuroinflamaciĂłn. Esta trĂada de disfunciĂłn tipifica y contribuye a la EA.
La carga de la EA en los niños y sus cuidadores
El profesor Paolo Amerio, ClĂnica de DermatologĂa, Departamento de Medicina y Ciencias del Envejecimiento, Universidad D'Annunzio Chieti-Pescara, Chieti, Italia, revisĂł la evidencia de que la EA pediátrica dificulta muchos aspectos del funcionamiento diario del niño. Los niños con EA de moderada a grave, generalmente experimentan brotes e infecciones de la piel frecuentes y duraderos, problemas para dormir y somnolencia diurna. La EA pediátrica tambiĂ©n puede tener consecuencias negativas a largo plazo en el curso de la vida del niño que surgen, por ejemplo, del impacto en la escolarizaciĂłn, la estigmatizaciĂłn social y las relaciones.1,9
El profesor Amerio señalĂł que, hasta hace poco, muchos estudios que evaluaban la carga impuesta por la EA se centraban en un solo centro, eran transversales en lugar de longitudinales y no se estratificaban segĂşn la gravedad de la enfermedad. Un análisis de subgrupos de la encuesta en lĂnea EPI-CARE, que incluyĂł a 517 niños de 6 meses a 6 años de Europa, abordĂł estas limitaciones.6
La carga sobre los pacientes y cuidadores aumenta a medida que la EA se vuelve más grave
La mayorĂa de los niños en EPI-CARE tenĂan EA leve. La proporciĂłn de niños que experimentaron más de dos brotes en el Ăşltimo mes aumentĂł del 4,9% de aquellos con EA leve al 22,3% y 46,9% en niños con EA moderada y grave, respectivamente.6
La proporción en la que la duración media del brote duró al menos 2 semanas aumentó del 9,0% de aquellos con EA leve al 24,5% y 49,2% en niños con EA moderada y grave, respectivamente.6
Otro estudio, que revisĂł los registros mĂ©dicos del Reino Unido, encontrĂł que los niños con EA de inicio temprano (≤7 años) tenĂan más probabilidades de desarrollar infecciones de la piel que aquellos con EA de inicio tardĂo (inicio entre 8 y 17 años).10 DespuĂ©s de ajustar por edad, sexo, duraciĂłn del seguimiento y otras comorbilidades atĂłpicas, aquellos con EA de inicio tardĂo tenĂan entre un 19% y un 26% menos de probabilidades de tener molusco contagioso (odds ratio [OR] 0.74), varicela o herpes zĂłster (OR 0.75), impĂ©tigo (OR 0.78) y herpes simple (OR 0.81) que aquellos con inicio de EA a los ≤7 años. Los niños con EA de inicio tardĂo tenĂan aproximadamente un 10% menos de probabilidades de tener celulitis (OR 0.90) y verrugas (OR 0.91) que aquellos con una edad de inicio más temprana.10
Comorbilidades atĂłpicas
La mayorĂa de los niños con EA tienen al menos una comorbilidad atĂłpica. La encuesta en lĂnea PEDIBURDEN incluyĂł a 160 niños de 6 a 11 años con EA moderada y grave. Las comorbilidades atĂłpicas comunes incluyeron: alergia al polen (52,5%); alergia al polvo o a los ácaros (46,3%); conjuntivitis alĂ©rgica (35,0%) y alergia alimentaria (33,1%).11 El profesor Amerio señalĂł que las comorbilidades atĂłpicas empeoraron varios resultados relacionados con la EA, incluida la privaciĂłn del sueño, en comparaciĂłn con los niños con EA sola.
La encuesta PEDI-BURDEN tambiĂ©n informĂł que aproximadamente la mitad de los niños con EA y aproximadamente la misma proporciĂłn de sus cuidadores habĂan dormido mal en la Ăşltima semana.7 Además:
- Los niños con EA informaron una media de 91,7 noches inquietas al año en comparación con 8,5 noches entre los niños sin EA.9
- Los niños con EA informaron sentirse somnolientos en una media de 63,1 dĂas al año en comparaciĂłn con 6,5 dĂas entre los niños sin EA.9
- Los cuidadores de niños con EA informaron trastornos del sueño en una media de 86,7 noches al año en comparación con 23,3 noches entre los padres de niños sin EA.9
- Los cuidadores se sintieron somnolientos en una media de 97,8 dĂas al año en comparaciĂłn con 25,8 dĂas entre los padres de control.9
Como sugieren los patrones de sueño de los cuidadores, la EA infantil afecta a toda la familia. La investigación del Estudio Pediátrico en Dermatitis Atópica (PEDISTAD) es un estudio longitudinal multinacional, basado en registros, en curso de niños menores de 12 años con EA moderada a grave que reciben medicamentos sistémicos para la EA, fototerapia o tratamientos tópicos, pero eran candidatos para la terapia sistémica. Según el Cuestionario de Impacto Familiar sobre Dermatitis (DFIQ), la EA afectó "bastante" o "mucho" a varias áreas de la vida familiar, incluidos los gastos (seleccionados por el 46,7% de los encuestados), el cansancio / agotamiento (40,7%), el sueño familiar (40,7%), la vida del cuidador debido al tratamiento de la EA (38,3%), la angustia emocional (37,5%), las tareas domésticas (32,6%), el ocio familiar (25,9%), la preparación / alimentación de alimentos (23,3%) y las relaciones familiares (18,4%).12
EvaluaciĂłn del impacto
El profesor Amerio señaló que varias herramientas capturan varios aspectos de la "experiencia vivida" de las personas con EA, que incluyen:
- El área de eccema y el Ăndice de gravedad (EASI) para los signos de EA.13
- La medida del eccema orientado al paciente (POEM) para los sĂntomas.14
- El ĂŤndice de Calidad de Vida de DermatologĂa Infantil (CDLQI)15 y el ĂŤndice de Calidad de Vida de la Dermatitis Infantil (IDQOL)16 para la calidad de vida (CdV) relacionada con la salud.
- RecapitulaciĂłn del eccema atĂłpico (RECAP) para el control de la enfermedad a largo plazo.17
Juntas, estas herramientas pueden construir una visiĂłn holĂstica del impacto de la EA en los pacientes. Sin embargo, es posible que los mĂ©dicos no tengan tiempo para implementar estas medidas en una práctica ocupada. Como mĂnimo, el profesor Amerio abogĂł por cuantificar la picazĂłn utilizando preguntas verbales simples, como "En los Ăşltimos 7 dĂas, Âżcuál fue la peor y la picazĂłn promedio en una escala de 1 a 10?". Como señalĂł el profesor Amerio, la picazĂłn es el sĂntoma más angustiante de la EA, que se correlaciona con la angustia mental y la falta de sueño.
Tratamiento actual de niños con EA de moderada a grave en todo el mundo
Dado el impacto en los pacientes, las familias y los cuidadores, los niños con EA moderada a grave necesitan tratamientos sistĂ©micos bien tolerados y eficaces, comentĂł la profesora Anna Belloni Fortina, Jefa de la Unidad de DermatologĂa Pediátrica del Departamento de Medicina de la Universidad de Padua, Italia.
Sin embargo, la evidencia del mundo real demuestra que muchos niños elegibles con EA de moderada a grave no reciben terapia sistémica.4 PEDISTAD, por ejemplo, informó que solo el 31,6% de los niños menores de 12 años que se consideran candidatos para recibir tratamiento sistémico recibieron medicamentos sistémicos para la EA, más comúnmente dupilumab (12,0%), corticosteroides sistémicos (10,2%), ciclosporina (9,3%) y metotrexato (8,7%).4
Actualmente, sin embargo, hay pocos datos longitudinales sĂłlidos a largo plazo que evalĂşen los resultados en niños con EA moderada a grave inadecuadamente controlada.30 PEDISTAD está recopilando datos sobre las caracterĂsticas y la progresiĂłn de los pacientes y la enfermedad, las comorbilidades atĂłpicas seleccionadas, los patrones de tratamiento en el mundo real, la eficacia y la seguridad durante 5 años.29,30
Al inicio del estudio, la EA afectĂł a una media del 33,3% (desviaciĂłn estándar [DE] 21,0%) del área de superficie corporal (ASC). La puntuaciĂłn media de EASI fue de 14,4 (DE 10,7) y la puntuaciĂłn media de POEM fue de 15,6 (DE 7,2). Muchos niños con EA experimentaron picazĂłn (65,0% experimentaron este sĂntoma todos los dĂas), con piel seca / áspera (62,0%), agrietada (40,7%) y descamaciĂłn (39,2%), y AD afectĂł el sueño (31,6%).29
Resultados sistémicos del tratamiento
El profesor Belloni Fortina presentó los resultados provisionales de PEDISTAD después de 2 años de seguimiento en tres cohortes de pacientes tratados con dupilumab (n = 144), metotrexato (n = 114) y ciclosporina (n = 121) La puntuación total de EASI mejoró en: 31
58,9% en comparaciĂłn con el valor basal despuĂ©s de una mediana del perĂodo de observaciĂłn del tratamiento de 8,1 meses 20,9 a 8,6) con dupilumab (p<0,001).
33,7% despuĂ©s de una mediana de observaciĂłn del tratamiento de 13,0 meses con metotrexato (16,6 a 1,0; p<0,001). La ciclosporina no se asociĂł con una diferencia estadĂsticamente significativa en la puntuaciĂłn total de EASI despuĂ©s de una mediana del perĂodo de observaciĂłn del tratamiento de 10,7 meses (18,8 a 15,5).
Los tres tratamientos, sin embargo, redujeron la BSA afectada:31
Dupilumab se asociĂł con una mejorĂa del 50,0% en la BSA afectada, disminuyendo del 39,8% al inicio del estudio al 19,9% (p<0,0001).
El metotrexato se asociĂł con una mejorĂa del 34,8% en los afectados por BSA (33,9% al inicio del estudio a 2,21%; p<0,0001).
La ciclosporina se asociĂł con una mejorĂa del 21,7% en los afectados por BSA (40,6% al inicio del estudio hasta 31,8%; p<0,001).
Dupilumab y metotrexato tambiĂ©n mejoraron los sĂntomas de la EA reportados por los pacientes. La puntuaciĂłn total media de POEM mejorĂł en un 38,5% (18,2 al inicio; 11,2 despuĂ©s de 8,1 meses; p<0,0001) con dupilumab y en un 26,7% con metotrexato (17,6 al inicio; 12,9 despuĂ©s de 13,0 meses; p<0,0001). La ciclosporina no se asociĂł con una diferencia estadĂsticamente significativa en la puntuaciĂłn total de POEM (17,5 al inicio del estudio; 16,0 despuĂ©s de 10,7 meses).31
La incidencia de eventos adversos basada en datos preliminares después de 2 años de seguimiento fue del 18,1% con dupilumab, del 28,9% con metotrexato y del 31,4% con ciclosporina, respectivamente.31
El profesor Belloni Fortina señalĂł que la mayorĂa de los niños inscritos en el estudio PEDISTAD no recibĂan terapia sistĂ©mica y estaban mal controlados con terapia tĂłpica.4 Por lo tanto, existe una importante necesidad mĂ©dica de tratamientos sistĂ©micos seguros y eficaces para la EA pediátrica moderada a grave.
Terapia sistĂ©mica dirigida para niños con EA: de los estudios clĂnicos a la práctica en el mundo real
El profesor Michael Cork, de la Universidad de Sheffield, Hospital de Niños de Sheffield, Reino Unido, señaló que los inmunosupresores sistémicos tradicionales no están aprobados actualmente para niños menores de 16 años y están asociados con efectos secundarios. Por ejemplo, la ciclosporina, utilizada para controlar los brotes agudos de la EA, puede aumentar la creatinina sérica y la presión arterial.32 El metotrexato y la azatioprina se usan como terapia de mantenimiento a largo plazo para las personas con EA, pero pueden causar efectos secundarios hematológicos y gastrointestinales, asà como aumentos en los niveles de enzimas hepáticas.32
Debido a los problemas de tolerabilidad, los inmunosupresores sistĂ©micos tradicionales requieren un control de seguridad regular. Por ejemplo, el monitoreo de ciclosporina y metotrexato incluye, entre otras pruebas, recuentos sanguĂneos completos y diferenciales, detecciĂłn de tuberculosis, funciĂłn renal y hepática y, si está indicado, pruebas de VIH.32 Un estudio de fase III, parte del programa LIBERTY que se analiza a continuaciĂłn, inscribiĂł a 367 niños de 6 a 11 años con EA grave. El tratamiento con niños con EA moderada a grave fue sostenido dupilumab más corticosteroides tĂłpicos (TCS) no se asociĂł con cambios clĂnicamente significativos en los parámetros de laboratorio para hematologĂa, quĂmica sĂ©rica o análisis de orina.33
El programa LIBERTY
El profesor Cork resumiĂł los resultados del programa LIBERTY, que inscribiĂł a niños de 6 a 11 años.34,35 LIBERTY AD PEDS aleatorizĂł a 367 niños con EA grave a placebo, dupilumab subcutáneo 300 mg cada 4 semanas o dupilumab subcutáneo cada 2 semanas (<30 kg: 100 mg; ≥30 kg: 200 mg) durante 16 semanas. Todos los niños tambiĂ©n recibieron TCS.34
LIBERTY AD PED OLE es un estudio de extensiĂłn abierta (OLE) en curso durante el cual 362 niños de LIBERTY AD PEDS o un estudio de fase II de 12 semanas de monoterapia con dupilumab recibieron dupilumab subcutáneo 2 mg/kg o 4 mg/kg semanalmente hasta que se dispusiera de datos farmacocinĂ©ticos y luego 300 mg cada 4 semanas. Los mĂ©dicos pueden aumentar la dosis a 200 mg cada 2 semanas si <60 kg o 300 mg cada 2 semanas si ≥60 kg y pueden prescribir TCS concomitante con o sin inhibidor tĂłpico de calcineurina. Los niños fueron seguidos por hasta 52 semanas. El objetivo de la OLE fue informar el perfil farmacocinĂ©tico y la seguridad y eficacia a largo plazo de dupilumab en niños (de ≥ a 6 <12 años) con EA grave.35
Dupilumab mejorĂł significativamente las tasas de respuesta de EASI-75 en la semana 16, que se mantuvo durante las 52 semanas de seguimiento. En niños con EA grave, placebo más TCS produjo una tasa de respuesta EASI-75 del 27%. Dependiendo del rĂ©gimen, dupilumab produjo tasas de respuesta EASI-75 de 67% y 70% (ambos p<0,0001).34 La mejorĂa en niños con EA moderada a grave se mantuvo: en la semana 52, el 79,4% mostrĂł una respuesta EASI-75.35
LIBERTY AD PEDS y LIBERTY AD PED OLE utilizaron la escala analĂłgica visual SCORing Atopic Dermatitis (SCORAD) (rango 0-10) para evaluar la picazĂłn. En LIBERTY AD PEDS, las puntuaciones de picazĂłn en niños de 6 a 11 años tratados con placebo más TCS disminuyeron de una media de 7,4 al inicio del estudio a 5,0 en la semana 16 (no significativa). Las puntuaciones en aquellos que recibieron dupilumab 300 mg más TCS disminuyeron de 7,8 al inicio del estudio a 2,6 en la semana 16 (p<0,001).36 Al ingresar al OLE, la puntuaciĂłn media del prurito fue de 3,8. La puntuaciĂłn continuĂł mejorando, alcanzando una media de 1,5 en la semana 52. En general, dupilumab redujo la gravedad del prurito de grave (puntuaciones de 7 a <9) a leve (0 a <4).36 El profesor Cork notĂł que la mejorĂa en la picazĂłn asociada con dupilumab comenzĂł a surgir despuĂ©s de la primera inyecciĂłn.
En un análisis post-hoc, dupilumab produjo mejoras sostenidas en la puntuación total de SCORAD durante las 52 semanas de seguimiento. La puntuación SCORAD total oscila entre 0 y 103. Las puntuaciones totales de SCORAD en niños tratados con placebo más TCS disminuyeron de una media de 72,9 al inicio a 51,1 en la semana 16 (no significativa). Las puntuaciones en aquellos que recibieron dupilumab 300 mg más TCS disminuyeron de 75.6 al inicio del estudio a 27.3 en la semana 16 (p<0.001).36 Al ingresar al OLE, la puntuación media de SCORAD fue de 35,5, que disminuyó a 18,8 en la semana 52 (no significativa). En general, dupilumab redujo la gravedad de la EA de grave (puntuaciones de >50) a leve (0-25) en la semana 16 (p<0,001).36
Mejoras en la calidad de vida
Dupilumab se asociĂł con mejoras significativas en la CdV para los niños con EA grave.37,38 En los niños tratados con placebo más TCS, el 35,8% de los ≥30 kg y el 48,3% de los <30 kg mostraron al menos una mejorĂa de seis puntos en la puntuaciĂłn CDLQI en la semana 16, lo que sugiere una mejorĂa significativa en la CdV. Ninguna de estas mejorĂas con placebo más TCS fue estadĂsticamente significativa en comparaciĂłn con el valor inicial. En la semana 16, el 81,8% de los que recibieron dupilumab 300 mg cada 4 semanas más TCS (p<0,001) y el 80,8% de los que recibieron dupilumab 200 mg cada 2 semanas más TCS (p<0,0001) mostraron al menos una mejorĂa de seis puntos en la puntuaciĂłn CDLQI.37,38 Dupilumab tambiĂ©n dio lugar a mejoras significativas en la CV para las familias de niños con EA grave. Para las familias de niños <30 kg que recibieron dupilumab 300 mg cada 4 semanas más TCS, el 73,4% informĂł una reducciĂłn en la carga familiar de la EA, que se evaluĂł mediante el DFIQ, en comparaciĂłn con el 38,7% del grupo placebo más TCS. Una proporciĂłn similar (75,4%) de las familias de niños ≥30 kg que recibieron dupilumab 200 mg cada 2 semanas más TCS informaron una mejorĂa en comparaciĂłn con el 40,6% del grupo de placebo más TCS.37
Eventos adversos
Dupilumab fue bien tolerado durante 16 semanas. El nĂşmero de eventos adversos emergentes del tratamiento que condujeron a la interrupciĂłn fue similar en los grupos placebo más TCS (1,7%) y dupilumab 300 mg cada 4 semanas más TCS (0%) y 100 o 200 mg cada 4 semanas más TCS (1,6%). Las infecciones cutáneas fueron numĂ©ricamente más frecuentes con placebo (13,3%) que con cualquiera de los grupos de dupilumab (300 mg: 5,8%; 100 o 200 mg: 8,2%).34 La conjuntivitis (300 mg: 6,7%; 100 o 200 mg: 14,8%) y las reacciones en el lugar de la inyecciĂłn (300 mg: 10,0%; 100 o 200 mg: 10,7%) fueron numĂ©ricamente más frecuentes con dupilumab que con placebo (4,2% y 5,8%, respectivamente). El profesor Cork señalĂł que la conjuntivitis era predominantemente ojo seco y, en su práctica clĂnica, la participaciĂłn temprana de un oftalmĂłlogo permite la implementaciĂłn de medidas de mejora. El perfil de seguridad fue consistente con otros grupos de edad estudiados. No se observaron nuevas señales de seguridad en niños con EA en comparaciĂłn con las observadas en adultos a las 16 semanas.34
El profesor Cork concluyó que las terapias dirigidas avanzadas pueden proporcionar mejores oportunidades de manejo para los niños con EA moderada a grave que los inmunosupresores sistémicos actuales.4,34-36,38
Relevancia de la señalización de tipo 2 en la EA
La inflamaciĂłn tipo 2 parece haber evolucionado como una respuesta inmune especializada para promover la inmunidad de barrera en las superficies mucosas, en particular para eliminar helmintos (por ejemplo, gusanos redondos) y para apoyar la reparaciĂłn de tejidos y la expulsiĂłn de gusanos.8,39 La creciente evidencia muestra que la inflamaciĂłn tipo 2 es uno de los mediadores clave de la disfunciĂłn de la barrera y la neuroinflamaciĂłn, que son caracterĂsticas de la fisiopatologĂa de la EA.
El profesor Donald Leung, Jefe de la DivisiĂłn de Alergia e InmunologĂa Pediátrica, National Jewish Health en Denver, Colorado, EE.UU., ha estudiado la inflamaciĂłn tipo 2 en la EA durante más de 30 años. SeñalĂł que en las personas con EA, la inflamaciĂłn tipo 2 interrumpe la funciĂłn y la integridad de la barrera cutánea, aumenta la permeabilidad y promueve la disbiosis (el desequilibrio de la flora cutánea normal).40 La inflamaciĂłn tipo 2 tambiĂ©n resulta en estimulaciĂłn neuronal, que en concierto con los cambios en la funciĂłn de barrera de la piel, impulsa el ciclo crĂłnico de picazĂłn / rascado.40
PicazĂłn e inflamaciĂłn tipo 2.
El profesor Leung revisó la evidencia de que la picazón (prurito) es un componente central de la inflamación tipo 2.41 La respuesta de picazón puede haberse desarrollado para alertar a los pacientes que están infestados y la respuesta de rascado para eliminar los parásitos de la superficie de la piel.41 El rascado desencadena la proliferación de queratinocitos y fibroblastos, lo que promueve la reparación de heridas y puede "aislar" los parásitos restantes.41-46
La inflamaciĂłn tipo 2 es la vĂa inflamatoria predominante en los subtipos de EA.47-52 Por ejemplo, las poblaciones de linfocitos Th2 y Th22 están marcadamente elevadas en europeos americanos, asiáticos, afroamericanos y niños con EA.47-52 TambiĂ©n hay algunas diferencias. Por ejemplo, las cĂ©lulas Th1 parecen aumentar en los estadounidenses de origen europeo y asiáticos con EA, pero no en los afroamericanos ni en los niños.47-52 El profesor Leung señalĂł que todavĂa hay mucho que aprender sobre la inflamaciĂłn tipo 2.
IL-4 e IL-13 son mediadores distintivos de la inflamaciĂłn tipo 2 y tienen mĂşltiples funciones superpuestas en la EA.40-53 IL-4 e IL-13 median la inflamaciĂłn y la disfunciĂłn de la barrera a travĂ©s de cambios inmunolĂłgicos y estructurales, mejoran las vĂas pruritogĂ©nicas y promueven la colonizaciĂłn con Staphylococcus aureus, que es comĂşn en personas con EA.40-53
El profesor Leung agregĂł que la composiciĂłn lipĂdica del estrato cĂłrneo es altamente anormal en las lesiones de EA. Por ejemplo, un cambio a lĂpidos de cadena corta en las lesiones de la EA permite que más agua se mueva a travĂ©s del estrato cĂłrneo. El bloqueo de la señalizaciĂłn de IL-4 e IL-13 con dupilumab restaura la composiciĂłn lipĂdica del estrato cĂłrneo y la funciĂłn de barrera cutánea en pacientes con EA moderada a grave.42 En particular, el bloqueo de la señalizaciĂłn de IL-4 e IL-13 produjo un aumento progresivo de los lĂpidos de cadena larga en el estrato cĂłrneo y una mejor pĂ©rdida de agua transepidĂ©rmica (TEWL) en comparaciĂłn con la lĂnea de base, lo que indica una funciĂłn cutánea normalizada. La mejora surgiĂł ya en el dĂa 15. En la semana 16, ninguno de los parámetros fue significativamente diferente en la piel lesionada en comparaciĂłn con la piel sana, lo que indica la normalizaciĂłn de la piel atĂłpica.54 La inflamaciĂłn tipo 2 desregulada tambiĂ©n impulsa la picazĂłn crĂłnica (ver más abajo).41 Los pruritogenos exĂłgenos (como los alĂ©rgenos y las proteasas liberadas por S. aureus) y la barrera cutánea de disfunciĂłn desencadenan una respuesta de estrĂ©s epitelial. Como resultado, los queratinocitos liberan alarminas ('señales de peligro'), incluyendo linfopoyetina del estroma tĂmico, IL-25 e IL-33, que activan las cĂ©lulas inmunes tipo 2 y estimulan la producciĂłn de citoquinas Th2, promoviendo la inflamaciĂłn y los cambios en la integridad de la barrera cutánea.41 Además, varios pruritogĂ©nicos pueden activar los receptores activados por proteasa (PAR)-2 en las neuronas sensoriales.41 En otras palabras, el eje tipo 2 conduce a una diafonĂa neuroinmune-epitelial mejorada entre queratinocitos, cĂ©lulas inmunes tipo 2, fibroblastos y pruriceptores (receptores de picazĂłn) en la piel, lo que induce y amplifica la picazĂłn.41
La inflamación tipo 2 actúa sobre una variedad de componentes de la barrera cutánea para impulsar la EA.
Muchos componentes estructurales y funcionales de la barrera epidĂ©rmica están desregulados en personas con EA, señalĂł la profesora Anna De Benedetto, profesora asociada de dermatologĂa del Centro MĂ©dico de la Universidad de Rochester, Rochester, NY, EE. ExplicĂł que la inflamaciĂłn tipo 2 impulsa esta desregulaciĂłn al influir en varios componentes esenciales para la estructura y funciĂłn normal de la piel. Por ejemplo, la inflamaciĂłn tipo 2 mejora la actividad de las proteasas, altera la expresiĂłn de varias proteĂnas estructurales (por ejemplo, filagrina, loricrina e involucrina) y aumenta los niveles de queratina 16. Las cĂ©lulas sanas de la piel no expresan queratina 16, que es parte de una respuesta que regula las señales de peligro, la inmunidad innata y la funciĂłn de barrera en la epidermis.40,55,56
En la piel sana, los lĂpidos repelentes al agua limitan la pĂ©rdida de agua y la penetraciĂłn de alĂ©rgenos y patĂłgenos. El profesor De Benedetto dijo que la inflamaciĂłn tipo 2 produce un metabolismo, funciĂłn y estructura de lĂpidos marcadamente disfuncionales en las lesiones de la EA.40 Por ejemplo, Elongases 3 y 6 (ELOVL3 y ELOVL6) estimulan la elongaciĂłn de ácidos grasos. IL-4 e IL-13 inhiben la expresiĂłn de ELOVL3 y ELOVL6. Los pacientes con EA muestran una disminuciĂłn de la expresiĂłn de ELOVL3 y ELOVL6. Como resultado, las ceramidas en el estrato cĂłrneo de las lesiones de EA tienen una longitud de cadena reducida, lo que contribuye a la disminuciĂłn de la hidrofobicidad.57
En la piel sana, las uniones estrechas sellan los espacios entre las cĂ©lulas. Esto forma la principal barrera para la difusiĂłn paracelular de fluidos, electrolitos, macromolĂ©culas y patĂłgenos.40 En las lesiones de EA, las uniones estrechas se vuelven permeables, lo que afecta la funciĂłn de barrera epidĂ©rmica.40 Las citocinas, incluidas las caracterĂsticas de la inflamaciĂłn tipo 2, debilitan las uniones estrechas en las lesiones de EA.40 Esto tiene varias consecuencias, incluyendo:40,58-65
FunciĂłn de barrera deteriorada.
Cambios en la posiciĂłn y densidad del nervio sensorial (p. ej., las dendritas neurales penetran en la epidermis de las lesiones de la EA).
RetenciĂłn de agua alterada.
Mayor susceptibilidad a la infecciĂłn viral (incluyendo eczema herpeticum).
Las dendritas de las cĂ©lulas de Langerhans (un tipo de cĂ©lula presentadora de antĂgeno) alcanzan la superficie de la piel de la EA y capturan alĂ©rgenos. Por lo general, las cĂ©lulas de Langerhans permanecen en las capas inferiores de la piel.
Además, las uniones estrechas claudina-1 y -3 evitan la fuga de sudor. En la EA, la pérdida de claudina-1 y -3 conduce a la fuga de sudor patógena.40,66 La inflamación tipo 2 socava la barrera formada por uniones estrechas y el estrato córneo que conduce a la fuga de sudor dentro de la epidermis. A su vez, la fuga de sudor resulta en: sequedad de la piel; retención de calor y reducción de la sudoración; mayor susceptibilidad a las infecciones; edema y picazón.40,63,66-68
El profesor De Benedetto agregó que la piel no lesional muestra una desregulación estructural y funcional similar a la de las lesiones de EA.69-71 De hecho, el aumento de la gravedad de la EA se correlaciona con una mayor interrupción de la barrera en la piel no lesionada en adultos y niños.69,70 Las comorbilidades atópicas pueden exacerbar la disfunción en la piel no lesional de las personas con EA. La alergia alimentaria, por ejemplo, se asocia con mayores alteraciones de la barrera cutánea no lesional en pacientes pediátricos con EA que en aquellos con piel sana.71 Los niños con sensibilización alérgica múltiple (cacahuete, huevo, gato o perro) muestran EA más grave y una mayor interrupción de la barrera cutánea que aquellos con EA y otras sensibilizaciones a alérgenos o piel sana.69
Disbiosis y EA
La colonizaciĂłn de la piel con S. aureus parece desarrollarse en una relaciĂłn que se refuerza mutuamente con los otros procesos patĂłgenos que subyacen a la EA. Por ejemplo, los pacientes con EA colonizada con S. aureus en su piel tienden a tener una enfermedad más grave, ejemplificada por una mayor disfunciĂłn de barrera, que aquellos que no albergan esta bacteria.72 Las toxinas, enzimas y otras proteĂnas liberadas por S. aureus, la causa más frecuente de brotes de EA inducidos por infecciĂłn, pueden desencadenar la producciĂłn de alarmina por los queratinocitos, activar los mastocitos, interrumpir la barrera epidĂ©rmica y estimular las respuestas inmunes innatas y tipo 2.40,73,74
Entre el 30% y el 100% de los pacientes con EA están colonizados con S. aureus en comparaciĂłn con el 5-30% de los controles sanos.73-75 S. aureus puede adherirse a la fibronectina y al fibrinĂłgeno.40 En las lesiones de EA, se observa tinciĂłn de fibronectina en los estratos superiores de la epidermis, particularmente en el estrato cĂłrneo. La piel sana no muestra este patrĂłn.75 La citoquina tipo 2 IL-4 aumenta la sĂntesis de procolágeno tipo I secretado y fibronectina entre dos y tres veces.76 La inflamaciĂłn tipo 2 tambiĂ©n promueve la colonizaciĂłn de S. aureus al reducir los niveles de pĂ©ptidos antimicrobianos y aumentar el pH de la piel.40 Además, los receptores MSCRAMM (Microbial Surface Components Recognizing Adhesive Matrix Molecules) en la superficie de S. aureus se unen a proteĂnas de la matriz extracelular expresadas en la piel.75
Tomados en conjunto, estos hallazgos sugieren que la inflamación tipo 2 puede fomentar la colonización de S. aureus. La disbiosis resultante parece tener un papel central en la patogénesis de la EA. El profesor De Benedetto comentó, sin embargo, que se necesita más investigación para determinar si inicialmente S. aureus desencadena la EA o si los cambios en la estructura de la piel preceden a la colonización.
El eje neuroinmune y el mecanismo neuroinflamatorio del prurito
Gil Yosipovitch, profesor de dermatologĂa de la Facultad de Medicina Miller de la Universidad de Miami y director del Miami Itch Center, Florida, EE.UU., señalĂł que la sensibilizaciĂłn neural es comĂşn en la EA. De hecho, la sensibilizaciĂłn neural impulsa la picazĂłn, el dolor, la sensaciĂłn de ardor y la piel sensible que suelen experimentar las personas con Alzheimer.79,80
El profesor Yosipovitch explicó que la inflamación tipo 2 contribuye a la sensibilización periférica y central (por ejemplo, reorganización cortical) y neuronal.79,80 En la piel de las personas con EA, los mediadores inflamatorios (p. ej., factor de crecimiento nervioso, prostaglandina E2 y artemina), la inervación anormal inducida por inflamación y rascado, y la activación de PAR-2 pueden inducir la sensibilización neural periférica.80
El profesor Yosipovitch enfatizĂł que la sensibilizaciĂłn neural no se limita a la periferia. La regulaciĂłn positiva de los receptores y molĂ©culas relacionados con el picor (por ejemplo, la sustancia P y el factor neurotrĂłfico derivado del cerebro) en los ganglios de la raĂz dorsal, la disfunciĂłn de los circuitos inhibitorios espinales y la atenuaciĂłn de las vĂas inhibitorias descendentes contribuyen a la sensibilizaciĂłn neural central.80 La picazĂłn prolongada tambiĂ©n produjo cambios funcionales y estructurales en la corteza prefrontal y la corteza cingulada anterior.80 Juntos, estos cambios dan como resultado la sensibilizaciĂłn neuronal central.
DiafonĂa neuronal y del sistema inmunitario
Existe una considerable diafonĂa entre los sistemas neural e inmunolĂłgico, que tienen una relaciĂłn muy dinámica, comentĂł el profesor Yosipovitch. La activaciĂłn de las cĂ©lulas inmunes y la liberaciĂłn de citoquinas tipo 2 y otros mediadores inflamatorios estimulan y mejoran directamente la funciĂłn neuronal en los sitios de inflamaciĂłn.81-84 Por ejemplo, varios neuropĂ©ptidos (por ejemplo, pĂ©ptido relacionado con el gen de la calcitonina, sustancia P y pĂ©ptido intestinal vasoactivo) liberados por neuronas sensoriales desreguladas actĂşan directamente sobre las cĂ©lulas inmunes, incluidos los eosinĂłfilos, las cĂ©lulas dendrĂticas, las cĂ©lulas linfoides innatas, los mastocitos, los macrĂłfagos y las cĂ©lulas T.81,82,84 La vĂa de citoquinas tipo 2 y las integrinas tambiĂ©n median la inducciĂłn de picazĂłn e inflamaciĂłn por periostina, una proteĂna de la matriz extracelular.85,86
Las citoquinas tipo 2 y otros mediadores que impulsan la actividad neuronal se originan a partir de interacciones complejas y dinámicas entre queratinocitos, células inflamatorias y terminaciones nerviosas, cascadas inmunes reguladas al alza, función de barrera epidérmica alterada y posible penetración de alérgenos en la piel.80 Varios factores modulan el impacto de estas interacciones, incluido el gradiente de pH, la integridad de la barrera cutánea, la exposición a irritantes y alérgenos, el microbioma (la colonización por S. aureus contribuye directamente a la neuroinflamación en la EA) y la neurosensibilización.80 87
El papel de los mastocitos
En ausencia de desencadenantes alĂ©rgicos, la expresiĂłn de la sustancia P en las fibras nerviosas y la expresiĂłn de triptasa aumentan en las lesiones de la EA. Al inicio del estudio, las lesiones de EA tambiĂ©n muestran una mayor densidad de mastocitos, particularmente en la pidermis, y distancias más cortas entre los mastocitos y los nervios sensoriales en comparaciĂłn con los controles.87 Además, los desencadenantes exĂłgenos pueden activar el receptor acoplado a proteĂna G relacionado con Mas-X2 (MRGPRX2), un receptor que activa los mastocitos y es un importante impulsor de la picazĂłn en la EA.87,88 La toxina δ de S. aureus puede activar directamente los mastocitos al unirse a MRGPRX2. Los microbios pueden impulsar la producciĂłn de pĂ©ptido de defensa del huĂ©sped, que tambiĂ©n activa MRGPRX2.87
A su vez, los mastocitos activados liberan histamina, que puede contribuir a la picazĂłn. El profesor Yosipovitch señalĂł, sin embargo, que los antihistamĂnicos H2 convencionales son en gran medida ineficaces en la EA, lo que subraya el papel de las vĂas independientes de la histamina. De hecho, varias otras molĂ©culas mediadoras de picazĂłn (como IL-31, proteasas, pĂ©ptidos y otros mediadores) se unen a los receptores en los pruriceptores, activando la vĂa independiente de la histamina.89,90 Las citoquinas tipo 2 tambiĂ©n regulan al alza la vĂa independiente de la histamina.91
De hecho, la vĂa no histaminĂ©rgica es la principal responsable de la picazĂłn crĂłnica experimentada por las personas con EA, lo que explica la escasa eficacia de los antihistamĂnicos convencionales.91 El profesor Yosipovitch argumentĂł que los basĂłfilos son la cĂ©lula efectora clave asociada con el brote agudo de picazĂłn en la EA desencadenada por IgE especĂfica del alĂ©rgeno.92 Los basĂłfilos activados por IgE tambiĂ©n producen grandes cantidades de IL-4.93 La activaciĂłn de basĂłfilos puede ayudar a explicar los brotes de picazĂłn experimentados por las personas con EA, sugiriĂł el profesor Yosipovitch.
MĂ©todos innovadores para evaluar la funciĂłn de barrera de la piel
El profesor Cork presentĂł un video desarrollado como parte del programa educativo ADVENT que explora cĂłmo los mĂ©todos innovadores para evaluar la funciĂłn de barrera de la piel ofrecen informaciĂłn sobre la fisiopatologĂa de la EA y el efecto de los tratamientos nuevos y existentes.
Una sonda en la piel mide de forma no invasiva TEWL al detectar cambios en la densidad del vapor de agua. Las directrices han ayudado a estandarizar la mediciĂłn de TEWL. Trazar TEWL contra el nĂşmero de tiras de cinta adhesiva permite calcular el área bajo la curva (TEWL AUC), que refleja la integridad del estrato cĂłrneo. Un AUC alto de TEWL refleja una mala integridad del estrato cĂłrneo. Un AUC TEWL bajo refleja una buena integridad. La mediciĂłn del AUC de TEWL puede ofrecer una mejor evaluaciĂłn de la integridad del estrato cĂłrneo que el TEWL basal solo. La extracciĂłn con cinta adhesiva cutánea es mĂnimamente invasiva y proporciona muestras para la evaluaciĂłn de microbiĂłmica, lipidĂłmica, proteĂłmica y transcriptĂłmica.
Biopsias virtuales de piel
La tomografĂa de coherencia Ăłptica (OCT) y la espectroscopia infrarroja por transformada de Fourier (FTIR) ofrecen una "biopsia virtual de piel" que permite evaluar la estructura de barrera. OCT proporciona una visualizaciĂłn tridimensional (3D) de la epidermis y la dermis papilar superior en resoluciĂłn a escala micromĂ©trica hasta 2 mm por debajo de la superficie.
La espectroscopia FTIR y Raman analiza de forma no invasiva la composiciĂłn quĂmica de la piel para proporcionar una huella molecular del estrato cĂłrneo que muestra informaciĂłn estructural sobre la barrera cutánea in vivo. Las dos tĂ©cnicas difieren en los mĂ©todos utilizados para crear una biopsia de piel virtual. La espectroscopia FTIR mide cuánta luz queda de la fuente original. La espectroscopia Raman mide la energĂa que se dispersa despuĂ©s de ser excitada por un láser.
Un espectrĂłmetro FTIR portátil puede detectar la funciĂłn de barrera de los pacientes con EA en la clĂnica. Esto permite la cuantificaciĂłn instantánea de los factores hidratantes naturales (NMF) y el efecto del tratamiento. La espectroscopia FTIR y Raman tambiĂ©n cuantifican la composiciĂłn lipĂdica estructural del estrato cĂłrneo, el contenido de agua y los niveles de NMF. La combinaciĂłn de la espectroscopia FTIR o Raman con la extracciĂłn de cinta adhesiva permite el análisis de toda la profundidad de la piel.
FotografĂa 2D y 3D
La fotografĂa bidimensional (2D) y 3D proporciona registros comparativos de la superficie de la piel que pueden ayudar a identificar cambios estructurales y funcionales en la funciĂłn de barrera, asĂ como a rastrear las mejoras clĂnicas. La fotografĂa tridimensional proporciona mayor detalle que las imágenes 2D, pero ambas ofrecen un registro altamente representativo de la mejora de la piel, especialmente desde la perspectiva del paciente.
Los filtros permiten el análisis de caracterĂsticas como el volumen, el eritema y la pigmentaciĂłn. Esto permite a los mĂ©dicos utilizar el Ăndice de viabilidad tisular. Los tonos amarillos y rojos representan una alta concentraciĂłn de eritrocitos, que se asocia con un aumento del eritema. Los tonos azules y verdes representan una baja concentraciĂłn de eritrocitos, que se asocia con una disminuciĂłn del eritema.
El video educativo ilustra que los mĂ©todos en evoluciĂłn para evaluar la funciĂłn de barrera de la piel proporcionan nuevos conocimientos sobre la patologĂa de la EA y cĂłmo estos mecanismos subyacentes responden a los tratamientos existentes y de investigaciĂłn. El uso de estos mĂ©todos en estudios clĂnicos mejorará la evaluaciĂłn de los efectos de los tratamientos sobre la funciĂłn de barrera cutánea en personas con EA en comparaciĂłn con controles sanos. Los profesionales de la salud pueden ver el video en el Programa ADVENT | EducaciĂłn mĂ©dica para mĂ©dicos sobre enfermedades inflamatorias tipo 2 | Dermatitis atĂłpica y asma.
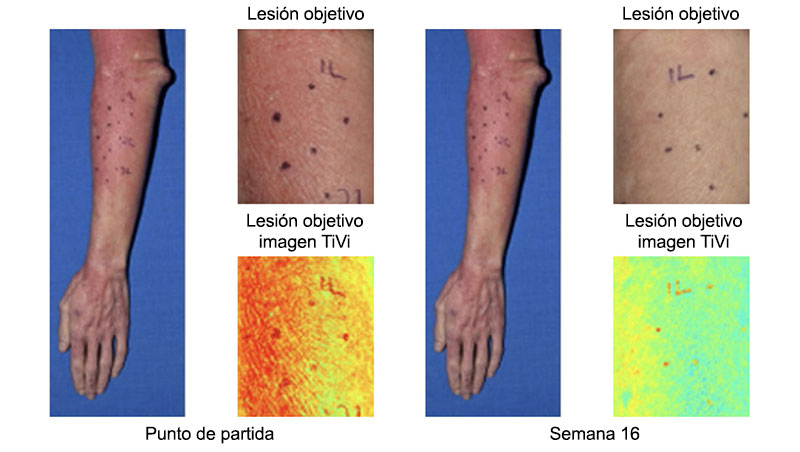
"Trabajar desde dentro": La normalización de la barrera cutánea como objetivo terapéutico
Los emolientes, los inmunosupresores tópicos (por ejemplo, TCS y tacrolimus), la ciclosporina y el dupilumab mejoran el TEWL basal de la piel lesionada en pacientes con EA moderada a grave, señaló el profesor Cork.94-96 Por ejemplo, durante la extracción secuencial de la piel, TEWL aumentó constantemente a una tasa reducida en sitios tratados con un emoliente que contiene urea, ceramida NP y lactato, lo que indica una mayor integridad del estrato córneo con el tiempo.94
Sin embargo, el profesor Cork señaló que el uso excesivo de TCS puede dañar la función de barrera.95 TEWL durante la extracción con cinta aumentó a una tasa significativamente menor con tacrolimus en comparación con la piel no tratada (p<0,0001) y la crema de valerato de betametasona (p<0,01).95 Además, un estudio comparó los cambios en TEWL con tres tratamientos. Los cambios en TEWL con TCS (-10.43 g/m2/h; p=0,047), ciclosporina (-7,73 g/m2/h; p=0,089) y dupilumab (-18,93 g/m2/h; p<0,001) sugirió mejoras en la función de barrera de la piel lesionada con EA. Sin embargo, en la piel no lesional, TEWL mejoró significativamente solo en pacientes que recibieron dupilumab (-3,62 g/m2/h; p=0,006).96
Un estudio retrospectivo investigĂł el efecto de dupilumab sobre la inflamaciĂłn y la barrera epidĂ©rmica utilizando tĂ©cnicas de inmunofluorescencia en pacientes con EA grave. El bloqueo de la señalizaciĂłn de IL-4 e IL-13 con dupilumab (n = 34; 300 mg cada 2 semanas despuĂ©s de una dosis de carga de 600 mg) normalizĂł los niveles de proteĂna estructural medidos mediante OCT. DespuĂ©s de 6-8 semanas de tratamiento con dupilumab, la OCT mostrĂł aumentos estadĂsticamente significativos en la expresiĂłn de filagrina (p<0,01), inhibidor linfoepitelial relacionado con Kazal (un inhibidor de la proteasa; p<0,01) y beta-defensina-3 humana (un pĂ©ptido antimicrobiano; p<0,001).97 En otro estudio, los pacientes con EA moderada a grave fueron aleatorizados para recibir dupilumab 200 mg semanales o placebo (ambos n = 27). DespuĂ©s de 16 semanas, dupilumab disminuyĂł la hiperplasia epidĂ©rmica y el engrosamiento (basado en la tinciĂłn de queratina 16) y aumentĂł los niveles de filagrina.98
El estudio BALISTAD
En este contexto, el estudio Dupilumab Skin Barrier Function Study in Atopic Dermatitis (BALISTAD) incluyĂł a 26 pacientes con EA de entre 12 y 65 años con EA moderada a grave, que eran elegibles para dupilumab y 26 controles sanos emparejados por edad, sexo, ubicaciĂłn corporal y sitio de estudio. Los pacientes recibieron una dosis de carga de dupilumab (600/400 mg) el dĂa 1, seguida de 300/200 mg cada 2 semanas hasta la semana 14.99
Al inicio del estudio, la TEWL fue significativamente diferente entre la piel sana y la piel lesionada y no lesional. En la semana 16, el bloqueo de la señalizaciĂłn de IL-4 e IL-13 normalizĂł la funciĂłn de barrera medida por TEWL despuĂ©s de cinco tiras de cinta adhesiva cutánea en piel lesional (p = 0.225 vs controles) y no lesional (p = 0.163). De hecho, el bloqueo de la señalizaciĂłn de IL-4 e IL-13 se asociĂł con un aumento progresivo de los lĂpidos de cadena larga en el estrato cĂłrneo que fue significativo ya en el dĂa 15 (Figura 8). Esto confirma una correlaciĂłn entre la mejora de los lĂpidos y la normalizaciĂłn de la funciĂłn de barrera. Los resultados clĂnicos e informados por los pacientes tambiĂ©n mejoraron en la semana 16.99
ResoluciĂłn de la disbiosis
El bloqueo de IL-13 con tralokinumab se asoció con una reducción 10 veces mayor desde el inicio en la abundancia de S. aureus (p<0.0001) y una mayor diversidad microbiana (p<0.001) en las lesiones de AD después de la semana 16.100 El bloqueo de la señalización de IL-4 e IL-13 con dupilumab (200 mg una vez a la semana) también redujo la abundancia de S. aureus en la piel y aumentó significativamente la diversidad del microbioma en comparación con placebo (p<0.001) durante 16 semanas de tratamiento.101
En un reciente estudio aleatorizado doble ciego, los pacientes recibieron 6 semanas de tratamiento con dupilumab seguido de una fase abierta de 10 semanas. La abundancia de S. aureus (cuantificada mediante reacciĂłn en cadena de la polimerasa) mostrĂł una marcada reducciĂłn de la piel lesional de la EA ya en el dĂa 3 (p = 0,02), que se hizo más significativa despuĂ©s de al menos 14 dĂas de seguimiento (p<0,001). Las reducciones significativas en la abundancia de S. aureus cuantificadas mediante cultivo tambiĂ©n surgieron ya en el dĂa 3 (p<0,001) en las lesiones de la EA.102 La piel no lesional mostrĂł una abundancia reducida a los 21 dĂas (p<0,001).102 El profesor Cork explicĂł que la normalizaciĂłn de la piel lesional parece reducir la adhesiĂłn de S. aureus, como se discutiĂł anteriormente.40,76
El profesor Cork concluyĂł que dirigirse a la inflamaciĂłn tipo 2, en particular IL-4 e IL-13, con productos biolĂłgicos puede mejorar significativamente la barrera epidĂ©rmica y normalizar la funciĂłn de barrera cutánea en pacientes con EA moderada a grave.94,96,98-100,102 La "normalizaciĂłn" de los mecanismos moleculares desregulados en la EA al dirigirse a la inflamaciĂłn tipo 2 puede restaurar la barrera cutánea y normalizar la funciĂłn de barrera, lo que se refleja en mejoras en los signos clĂnicos, los sĂntomas y la CdV de los pacientes.54,99
ADVENT.
Estos simposios son parte de ADVENT, un programa de educaciĂłn mĂ©dica no promocional para profesionales de la salud, organizado por Sanofi y Regeneron Pharmaceuticals, para avanzar en la comprensiĂłn de la inflamaciĂłn tipo 2. ADVENT, una colaboraciĂłn con más de 50 expertos globales, vincula la ciencia más reciente de la inflamaciĂłn tipo 2 con el manejo clĂnico para mejorar la atenciĂłn al paciente. Puede acceder al programa en: www.adventprogram.com.
Referencias.
Silverberg JI et al. Ann Allergy Asthma Immunol 2021;126:417–428.e2
Barbarot S et al. J Pediatr 2022;246:220–226.e5
Cork MJ et al. J Dermatolog Treat 2020;31:801–809
Paller A et al. Presentado en ESPD 2022; ReuniĂłn hĂbrida; 20 y 22 de mayo de 2022
de Carvalho V et al. Presentado en RAD 2022; 9 – 12 abril. Cartel 211
Weidinger S et al. Presentado en la reuniĂłn del DEUC, 20 y 22 de mayo de 2022
Silverberg J et al. Presentado en el SPD; Del 8 al 10 de julio de 2021
Gandhi NA et al. Nat Rev Drug Discov 2016;15:35–50
Baiardini I et al. Presentado en el congreso EADV; 7 al 10 de septiembre de 2022
Shah S et al. Póster presentado en la Reunión Anual de SID. 18–21 de mayo de 2022
Galli E et al. Presentado en el congreso EADV; 7 al 10 de septiembre de 2022
de Bruin-Weller M et al. Presentado en el congreso EADV; 7 al 10 de septiembre de 2022
Hanifin JM et al. Exp Dermatol 2001;10:11-8
Charman CR et al. Arch Dermatol 2004;140:1513-9
Lewis-Jones MS, Finlay AY. Br J Dermatol 1995;132:942-9
Lewis-Jones MS et al. Br J Dermatol 2001;144:104-10
Howells LM et al. Br J Dermatol 2020;183:524-536
RamĂrez FD et al. JAMA Pediatr 2019;173:e190025
Neri I et al. Presentado en EADV; 7 al 10 de septiembre de 2022
Silverberg J et al. Presentado en EADV; 7 al 10 de septiembre de 2022
Huang AH et al. J Am Acad Dermatol 2021;85:893–900
Ong PY, Leung DY. Immunol Allergy Clin North Am 2010;30:309–321
Paller A et al. Presentado en AAD 2022; 25–29 de marzo
Weidinger S et al. Presentado en la conferencia virtual del SPD; 8–10 de julio de 2021
Pálsson K et al. J Eur Acad Dermatol Venereol 2021;35:1849–1858
Hou A, Silverberg JI. Pediatr Dermatol 2021;38:606–612
Kern C et al. JAMA Dermatol 2021; 157:1200–1208
Stingeni L et al. J Alergia al asma 2021;14:919–928
Paller AS et al. J Am Acad Dermatol 2022;DOI:10.1016/j.jaad.2022.01.018
Paller AS et al. BMJ Abierto 2020;10:e033507
Paller AS et al. Presentado en EADV; 7 al 10 de septiembre de 2022
Sidbury R et al. J Am Acad Dermatol 2014;71:327–349
Paller AS et al. Medicamentos pediátricos 2021;23:515–527
Paller AS et al. J Am Acad Dermatol 2020;83:1282–1293
Cork MJ et al. Br J Dermatol 2021;184:857–870
Wollenberg A et al. Acta Derm Venereol 2022;102:adv00726
Paller AS et al. Presentado en el Congreso Digital AAD 2021; 23 y 25 de abril
Irvine A et al. Presentado en el Congreso Digital de AAD; 23 y 25 de abril de 2021. P27431
Haddad EB et al. Dermatol Ther (Heidelb) 2022;12:1501-1533
Beck LA et al. JID Innovations 2022;2:DOI:10.1016/j.xjidi.2022.100131
Garcovich S et al. Vacunas 2021;9:303
Allen JE, Sutherland TE. Semin Immunol 2014;26:329-40
Makepeace BL et al. Curr Med Chem 2012;19:1567-86
Inclan-Rico JM, Siracusa MC. Tendencias Parasitol 2018;34:861-880
de Kouchkovsky DA et al. Tendencias Immunol 2017;38:154-167
Weatherhead JE et al. Frente Immunol 2020;11:594520
Noda S et al. J Alergia Clin Immunol 2015;136:1254–1264
Sanyal RD et al. Ann Allergy Asthma Immunol 2019;122:99–110.e6
Brunner PM, Guttman-Yassky E. Ann Alergia Asma Immunol 2019;122:449–455
Brunner PM et al. J Alergia Clin Immunol 2018;141:2094–2106
Esaki H et al. J Allergy Clin Immunol 2016;138:1639–1651
Brunner PM et al. Ann Allergy Asthma Immunol 2019;122:318–330.e3
Farag AK et al. Alergia 2022;77:1245–1253
Berdyshev E et al. Alergia DOI:10.1111/ all.15432
Suárez-Fariñas M et al. J Allergy Clin Immunol 2011;127:954–64.e1–4
Lessard JC et al. Proc Natl Acad Sci USA 2013;110:19537–19542
Berdyshev E et al. JCI Insight 2018;3:DOI:10.1172/jci.insight.98006
Bergmann S et al. Sci Rep 2020;10:2024
Furuse M et al. J Cell Biol 2002;156:1099–1111
Sugawara T et al. J Derm Sci 2013;70:12–18
Nadeau P et al. J Alergia Clin Immunol 2018;142:281–284.e7
De Benedetto A et al. J Allergy Clin Immunol 2011;128:242–246.e5
De Benedetto A et al. J Clin Med 2015;4:741–55
Gruber R et al. Am J Pathol 2015;185:2777–2789
Takahashi S et al. Sci Rep 2019;9:8625
Yamaga K et al. J Invest Dermatol 2018;138:1279–1287
Hönzke S et al. J Invest Dermatol 2016;136:631–639
Yokouchi M et al. J Dermatol Sci 2015;77:28–36
Sherenian MG et al. Clin Exp Allergy 2021;51:666–673
Yoshida T et al. Allergol Int 2022;71:3–13
Leung DYM et al. Sci Transl Med 2019;11:eaav2685
Simpson EL et al. J Invest Dermatol 2018;138:2224–2233
Kim J et al. Alergia Asma Immunol Res 2019;11:593–603
Paller AS et al. J Allergy Clin Immunol 2019;143:26–35
Cho SH et al. J Allergy Clin Immunol 2001;108:269–74
Postlethwaite AE et al. J Clin Investig 1992;90:1479–1485
Nedoszytko B y otros Int J Mole Sci 2020;21:6484
Serezani APM et al. J Allergy Clin Immunol 2017;139:142–151.e5
Baliki MN, Apkarian AV. Neuron 2015;87:474–491
Yosipovitch G et al. Acta Derm Venereol 2019;99:1201–1209
Kabata H, Artis D. J Clin Invest 2019;129:1475–1482
Mack MR, Kim BS. Trends Immunol 2018;39:980–991
Zeidler C, Ständer S. Eur J Pain 2016;20:37–40
Ohanyan T et al. Acta Derm Venereol 2018;98:26–31
Ono J et al. Biomoléculas 2021;11:1084
Hashimoto T et al. J Invest Dermatol 2021;141:2338–2343
Wang Z, Babina M. Exp Dermatol 2020;29:1104–1111
Navinés-Ferrer A et al. Sci Rep 2018;8:11628
Paller AS et al. J Alergia Clin Immunol 2017;140:633–643
Kühn H et al. J Alergia Clin Immunol 2021;147:456–469
Yang TB, Kim BS. J Alergia Clin Immunol 2019;144:353–360
Wang F et al. Celda 2021;184:422–440.e17
Brunner T et al. J Exp Med 1993;177:605–11
Danby SG et al. Skin Pharmacol Physiol 2016;29:135–47
Chittock J et al. Acta Derm Venereol 2015;95:653–8
Montero-Vilchez T et al. J Clin Med 2022;11:DOI:10.3390/jcm11123341
Rohner MH et al. Alergia 2021;76:1268–1270
Guttman-Yassky E et al. J Alergia Clin Immunol 2019;143:155–172
Bissonnette R et al. Presentado en la Conferencia RAD; 11 y 13 de diciembre de 2021
Bieber T et al. Presentado en AAD VMX; 23-25 de abril de 2021; ID del pĂłster: 28170
Callewaert C et al. J Invest Dermatol 2020;140:191–202.e7
Beck LA. Presentado en AAAI. 25 y 28 de febrero de 2022. PresentaciĂłn 2521

Recomendamos