La AEMPS actualiza el listado de implantes de relleno utilizados con finalidad plástica, reconstructiva y estética
Los implantes de relleno con una finalidad médica reconstructiva, asà como los que tienen una finalidad exclusivamente estética, tienen que cumplir con la legislación de los productos sanitarios
-
ESAM Medicina Estética, un nuevo impulso para el sector
-
En Barcelona se celebra Cosmetics & Aesthetics Forum, una jornada que une cosmética profesional y medicina estética
Un encuentro estratégico que consolida el modelo de belleza integral y multidisciplinar en 2026
-
Cellfina, el tratamiento definitivo contra la celulitis
Cellfina, de Merz Aesthetics, es el Ăşnico procedimiento mĂnimamente invasivo aprobado por la UE para tratar los hoyuelos y la piel de naranja caracterĂsticos de la celulitis. Ahora aterriza desde EE UU al Centro de DermatologĂa Pedro JaĂ©n
-
Tendencias 2026 en estética masculina: qué piden los hombres hoy
Cada vez más hombres recurren a tratamientos para proyectar seguridad, juventud y bienestar. En 2026, esta tendencia se afianza con mejoras sutiles, naturales, con mĂnima recuperaciĂłn y capaces de reforzar la personalidad masculina
-
Monte-Carlo acoge el AMWC 2026, epicentro mundial de la medicina estética y antienvejecimiento
La 24ÂŞ ediciĂłn del congreso internacional se celebrará del 26 al 28 de marzo en el Grimaldi Forum, bajo el Alto Patrocinio del PrĂncipe Alberto II de MĂłnaco
-
De corregir a prevenir: la Dra. Beatriz Beltrán analiza las tendencias que marca el IMCAS
La medicina estética evoluciona hacia un modelo preventivo, regenerativo y tecnológico, centrado en el diagnóstico médico y el abordaje integral del envejecimiento
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha actualizado el listado de implantes de relleno utilizados con finalidad plástica, reconstructiva y estética con marcado CE que constan comunicados en el Registro de Comercialización de Productos Sanitarios de la AEMPS. Este listado está disponible en una nueva sección de la web de la AEMPS en la que puede consultarse toda la información al respecto sobre los implantes de relleno con finalidad plástica, reconstructiva y estética.
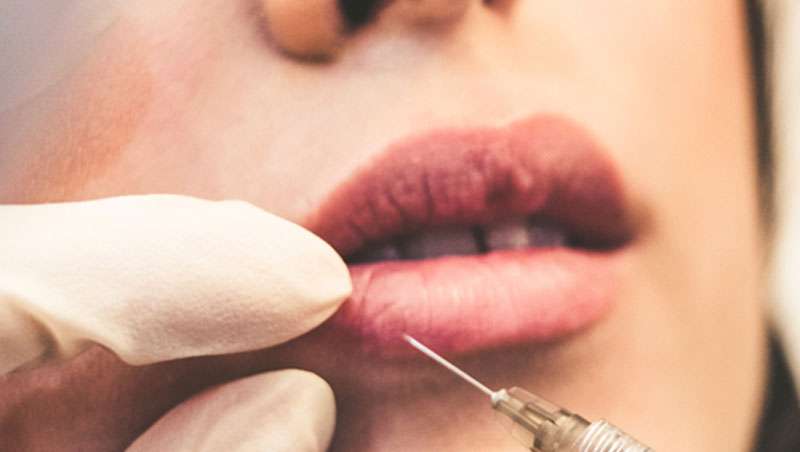
Los productos que se utilizan como relleno facial o en otras zonas dérmicas y que se aplican mediante inyección, aguja u otro sistema de aplicación, tienen la consideración de producto sanitario siempre que estén destinados por su fabricante a una finalidad médica, como es una finalidad reconstructiva, y que no ejerzan su acción principal en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales mecanismos.
Sin embargo, los implantes de relleno con una finalidad exclusivamente estética, como puede ser la corrección de arrugas, pliegues o para el aumento de pómulos o labios o realzar distintas zonas corporales, están considerados productos sanitarios sin finalidad médica prevista, incluidos en el Anexo XVI del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo de 5 de abril de 2017 sobre los Productos Sanitarios.
Además de los productos citados, tambiĂ©n se utilizan con finalidad estĂ©tica diferentes medicamentos que contienen como principio activo toxina botulĂnica en una indicaciĂłn estĂ©tica. Su utilizaciĂłn debe ajustarse al contenido de su ficha tĂ©cnica y tener en cuenta la informaciĂłn, precauciones y recomendaciones efectuadas por esta Agencia. Puede obtenerse la informaciĂłn más actualizada sobre dichos medicamentos en CIMA, el Centro de InformaciĂłn Online de Medicamentos de la AEMPS.
Por otro lado, conviene aclarar que los productos comercializados como cosmĂ©ticos, aunque tengan un fin estĂ©tico y se presenten en viales o ampollas, segĂşn lo establecido en su reglamentaciĂłn, no pueden ser inyectados, al estar esta vĂa de aplicaciĂłn excluida de su definiciĂłn legal. Inyectar un producto cosmĂ©tico, es un mal uso de los mismos y supone un riesgo para la salud pĂşblica. Por esa razĂłn, la AEMPS publicĂł la nota Informativa 1/2020 informado sobre el buen uso de los cosmĂ©ticos que se presenten en viales o ampollas.
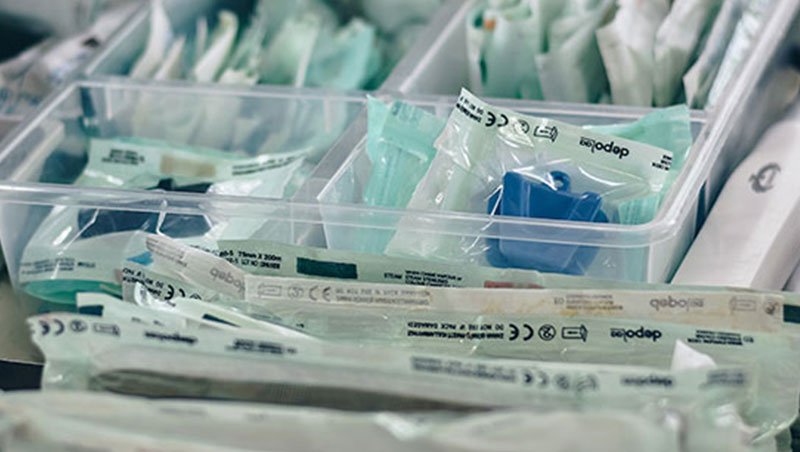
Requisitos para la comercializaciĂłn
Estos productos solo pueden comercializarse si cumplen con las disposiciones establecidas en el Reglamento (UE) 2017/745 y en España con el Real Decreto 192/2023. Esta legislación resultará asimismo aplicable a los productos sin finalidad médica enumerados en el Anexo XVI a partir de la fecha de aplicación de las especificaciones comunes aplicables a estos productos (Reglamento 2022/2346 de la Comisión).
Para ello, tienen que estar provistos de marcado CE, distintivo que declara la conformidad del producto con los requisitos de seguridad y funcionamiento establecidos en la legislaciĂłn. El marcado CE debe figurar en el etiquetado y las instrucciones de uso del producto, acompañado de un nĂşmero de cuatro dĂgitos que identifica el organismo notificado responsable de los procedimientos de la evaluaciĂłn de conformidad del producto.
El etiquetado y las instrucciones de uso de los productos que se distribuyan en España deben cumplir también con los requisitos exigidos en el apartado 23 del Anexo I de dicho reglamento y venir, al menos, en castellano.
Los productos deberán utilizarse en las condiciones y según las finalidades previstas por el fabricante, no comprometiendo la seguridad y la salud de los pacientes ni, en su caso, de terceros.
Para garantizar la correcta utilización de los productos, los profesionales que los utilicen deberán estar debidamente cualificados y formados. Además, los profesionales sanitarios, que, con ocasión de su actividad, tengan conocimiento de un incidente grave, deberán notificarlo a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) a través de NotificaPS a través del cual pueden ser notificados los incidentes también por parte de pacientes y personas usuarias.

Recomendamos